Rumus Kimia
Seperti yang telah disinggung rumus kimia merupakan salah satu ciri khas senyawa kimia. Rumus kimia suatu senyawa menyatakan
lambang dan jumlah atom unsur yang menyusun suatu senyawa tanpa
menyebut senyawa tersebut termasuk senyawa ionik atau kovalen. Rumus kimia sendiri terbagi menjadi rumus empiris dan rumus molekul.
Rumus molekul dan rumus empiris suatu senyawa
hanya terjadi perbedaan jumlah atom, sedangkan atom unsur penyusun
senyawa tetap. Namun demikian beberapa senyawa memiliki rumus molekul
dan rumus empirisnya yang sama, misalnya H2O (air) dan NH3 (amoniak).
Jumlah atom dalam suatu rumus kimia menyatakan
jumlah mol dari unsur terkait, jadi rumus kimia suatu senyawa merupakan
perbandingan mol atom unsur penyusun senyawa tersebut. Dari perbandingan
atom atau perbandingan mol ini dapat ditentukan perbandingan massa dan %
massa dari unsur-unsur yang menyusun senyawa tersebut.
Untuk memperjelas hal ini perhatikan contoh berikut! misalnya vitamin C yang mengandung asam askorbat dengan rumus molekul C6H8O6, maka:
· Rumus molekul C6H8O6
· Perbandingan mol atom unsur
C : H : O = 6 : 8 : 6
· Perbandingan massa unsur
C : H : O = 6 x Ar. C : 8 x Ar.H : 6 x Ar.O
= (6 x 12) : (8 x 1) : (6 x 16)
= 72 : 8 : 96
· Jumlah perbandingan = Mr
72 + 8 + 96 = 176
· % massa masing-masing unsur
Berikut adalah rumus untuk menghitung % massa unsur dalam senyawa
Contoh soal menentukan kadar unsur dalam senyawa
Berapa persen (%) C, O, N dan H yang terdapat dalam urea, CO(NH2)2, jika diketahui Ar.C = 12, Ar.O = 16, Ar.N = 28 dan Ar.H =1?
Jawab
Langkah penyelesaian
1. Tentukan mol masing unsur-unsur dalam senyawa
Atom C = 1 mol
Atom O = 1 mol
Atom N = 2 mol
Atom H = 4 mol
2. Dari mol atom tentukan massa masing-masing unsur dalam senyawa
dengan cara: kalikan dengan atom relatif (Ar) masing-masing atom
Atom C = 1 mol x 12 g/mol = 12 g
Atom O = 1 mol x 16 g/mol = 16 g
Atom N = 2 mol x 14 g/mol = 28 g
Atom H = 4 mol x 1 g/mol = 4 g
3. Jumlahkan massa semua atom yang telah diperoleh untuk memperoleh massa molekul (massa molekul relatif) 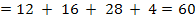
Atau dengan cara
4. Tentukan % massa masing-masing unsur dengan cara:
Massa masing-masing atom dibagi dengan massa semua atom dalam senyawa (massa molekul relatif) kemudian dikali 100%.
Dengan cara ini diperoleh:
Jika terdapat 120 Kg urea maka massa N adalah sebesar = 46, 67% x 120 Kg = 56 Kg.
Rumus Empiris dan Rumus Molekul
Rumus Empiris
Rumus empiris adalah rumus kimia yang menyatakan
perbandingan terkecil jumlah atom-atom pembentuk senyawa. Misalnya
senyawa etena yang memiliki rumus molekul C2H4, maka rumus empiris senyawa tersebut adalah CH2.
Dalam menentukan rumus empiris yang dicari terlebih
dahulu adalah massa atau persentase massa dalam senyawa, kemudian dibagi
dengan massa atom relatif (Ar) masing-masing unsur. artinya untuk
menentukan rumus empiris yang perlu dicari adalah perbandingan mol dari
unsur-unsur dalam senyawa tersebut.
Contoh
Suatu senyawa mengandugn 64,6 g natrium, 45,2 g belerang dan 90 g
oksigen. Jika diketahui Ar.N = 23, Ar.S = 32, ddan Ar.O = 16. Maka
tentukan rumus empiris senyawa tersebut?
Jawab
Jadi rumus empiris senyawa tersebut adalah Na2SO4.
Rumus Molekul
Rumus molekul adalah rumus kimia yang menyatakan jenis dan jumlah atom yang menyusun suatu senyawa. Misalnya: C2H4 (etena), CO(NH2)2 (urea) dan asam asetat atau asam cuka (CH3COOH). Rumus molekul dapat didefinisikan sebagai rumus kimia yang menyatakan perbandingan jumlah dan jenis atom sesungguhnya dari suatu senyawa.
Dari rumus molekul asam cuka diketahui bahwa rumus molekul tersebut tidak ditulis C2H4O2. Beberapa alasan rumus molekul asam cuka tidak ditulis demikian yaitu
1. Untuk membedakan dengan senyawa lain yang memiliki jumlah atom penyusun yang sama misalnya metil format (HCOOCH3).
2. Rumus molekul menggambarkan struktur molekul. Artinya dari rumus
molekul kita dapat menunjukan atom-atom saling berikatan. Pada molekul
asam cuka atom C yang pertama mengikat 3 atom H dan 1 atom C berikutnya
dan atom C berikunya mengikat 2 atom O kemudian 1 atom O mengikat 1 atom
H.
Contoh soal menentukan rumus molekul dari rumus empiris
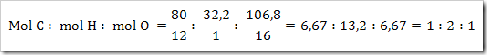
200 g senyawa organik mempunyai massa molekul relatif =
180, senyawa ini terdiri dari 40% karbon, 6,6% hidrogen dan sisanya
adalah oksigen. Jika diketahui Ar.C = 12, Ar.H = 1, dan Ar.O = 16. Maka
tentukan rumus molekul senyawa ini?
Jawab
Jadi rumus empiris senyawa tersebut adalah CH2O
Dari rumus molekul yang telah diperoleh maka rumus molekul dapat ditentukan sbagai berikut
CH2O)n
(Ar C x n) + (2.Ar H x n) + (Ar.O) = Mr senyawa
12n + 2n + 16n = 180
30n = 180
n = 6
jadi rumus molekulnya adalah C6H12O6.
Menentukan Rumus Empiris dan Rumus Molekul Berdasarkan Ar dan Mr
Tentukan rumus molekul yang dimiliki senyawa dengan umus empiris CH, jika diketahui Mr senyawa tersebut adalah 78?
Jawab
Mr senyawa = (CH)n
78 = (12 + 1)n
78 = 13n
n = 6
jadi rumus molekul yang dimiliki senyawa tersebut adalah (CH)n = C6H6.
Contoh Soal
Massa molekul relatif suatu senyawa organik yang memiliki rumus empiris CH2O adalah 180, jika diketahui Ar.C= 12, Ar.H =1 Ar.O = 16, tentukan rumus molekul senyawa tersebut?
Jawab
Mr senyawa = (CH2O)n
180 = (12 + 2+ 16)n
180 = 30n
n = 6
jadi rumus molekul yang miliki senyawa tersebut adalah (CH2O)n = C6H12O6
Persamaan Reaksi
Seperti yang telah disinggung pada bab sebelumnya, bahwa perubahan kimia yang terjadi pada materi disebut juga reaksi kimia. Reaksi kimia yang terjadi dapat berlangsung secara eksoterm dan endoterm.
Reaksi berlangsung secara eksoterm bila reaksi yang terjadi disertai
pembebasan sejumlah energi, sedangkan kebalikan dari reaksi eksoterm
disebut reaksi endoterm. Energi yang terlibat dapat berupa energi
cahaya, energi panas dan energi-energi yang lainnya.
Pada reaksi kimia terdapat zat awal yang belum
mengalami perubahan yang disebut reaktan atau pereaksi dan zat yang
telah mengalami perubahan yang disebut produk atau zat hasil reaksi.
Zat-zat yang terlibat dalam reaksi kimia dapat berupa unsur dan senyawa.
Rekasi yang dimaksud disini bukan reaksi fisi atau reaksi fusi,
sehingga zat-zat sebelum dan sesudah reaksi adalah zat-zat yang sama.
Reaksi kimia yang terjadi biasanya tulis dalam bentuk persamaan reaksi.
Persamaan reaksi merupakan pernyataan yang mengungkapkan atau
menggambarkan suatu proses kimia dengan menggunakan rumus kimia. Karena
itu penulisan persamaan reaksi harus dapat menyatakan fenomena kimia
yang sebenarnya, dimana zat-zat yang bereaksi dan zat-zat hasil reaksi
harus tergambarkan dengan jelas. Agar lebih jelas perhatikan reaksi yang
terjadi antara gas hidrogen dan gas oksigen untuk membentuk air, yang
digambarkan sebagai berikut:
Keterangan:
· Huruf kecil dalam tanda kurung yang setelah rumus kimia (yang ditulis miring) menyatakan wujud zat. Wujud zat dinyatakan dengan singkatan yakni
§ s (solid) untuk zat berwujud padat
§ l (liquid) untuk zat berwujud cair
§ g untuk zat berwujud gas
§ aq (aqueous, baca: akues) untuk zat yang larut dalam air.
· Bilangan yang mendahului rumus kimia (2 pada H2, 1 pada O2 dan 2 pada H2O)
disebut koefisien reaksi. Koefisien reaksi untuk menyetarakan jumlah
atom atau jumlah molekul atau jumlah ion sebelum dan sesudah reaksi.
Pada contoh di atas dapat diketahui bahwa jumlah atom sebelum dan sesudah reaksi adalah sama, hal ini disebut persamaan setara. Berikut adalah penjumlahannya:
· Jumlah atom H di ruas kiri = jumlah atom H di ruas = 4
· Jumlah atom O di ruas kiri = jumlah atom O di ruas = 2
Untuk keperluan tertentu, persamaan reaksi dibubuhkan atribut lain.
Berikut adalah beberapa atribut yang biasa ditemukan pada persaaman
reaksi:
· Warna zat
· Δ ada bawah atau atas anak panah= tanda proses pemanasan
· = tanda kesetimbangan
· ΔH = harga perubahan entalpi
· E° = harga potensial elektrode
Tujuan dan Penyetaraan Persamaan Reaksi
Tujuan dari penyetaran persamaan reaksi yaitu untuk
memenuhi hukum kekekalan massa atau hukum Lavoisier dan teori atom
Dalton. Hukum kekealan massa berbunyi “dalam sistem tertutup massa zat sebelum dan setelah reaksi adalah tetap” dan tori atom dalton menyatakan “dalam reaksi kimia tidak ada atom yang hilang atau tercipta tetapi hanya terjadi penataan ulang”. Artinya jumlah dan jenis atom dalam reaksi kimia adalah tetap atau sama.
Agar jumlah dan jenis atom yang terdapat pada reaktan
dan produk tetap maka pada persamaan reaksi masing-masing spesi yang
terlibat dalam reaksi kimia diberi koefisien yang sesuai. Seperti pada contoh pembentukan H2O
koefisien reaksi menyatakan jumlah atom, jumlah ion ataupun jumlah
molekul, namun selain itu kofisien reaksi juga menyatakan mol zat yang
terlibat dalam reaksi kimia. Misalnya contoh pembentukan air:
Koefisien yang dimiliki menyetakan 2 mol gas
hidrogen bereaksi dengan 1 mol gas oksigen membentuk 2 mol air atau 2
molekul gas hidogen bereaksi dengan 1 molekul gas oksigen membentuk 2
molekul air.
Berikut adalah langkah-langkah menulis persamaan reaksi dan penyetaraannya
Misalnya logam aluminium bereaksi dengan gas O2 membentuk aluminium oksida. Tulislah persamaan reaksi dan penyetaraannya?
1) Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2) Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi yang rumus kimianya lebih kompleks).
Pada reaksi di atas spesi yang lebih kompleks adalah Al2O3 = 1
3) Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Koefisien Al2O3 = 1
Maka Al diruas kanan = 2
Al diruas kiri = 1
Agar jumlah atom Al pada kedua ruas sama maka Al pada ruas kiri diberi kofisien 2. Mka persamaan reaksinya menjadi:
Atom O
Koefisien Al2O3 = 1
Maka atom O diruas kanan = 3
Jumlah atom O diruas kiri = 2
Agar jumlah atom O pada kedua ruas sama maka atom O pada ruas kiri diberi koefisien 3/2. Persamaan reaksinya menjadi:
Agar koefisien tidak dalam bentuk pecahan koefisien pada kedua ruas
dikalikan dengan satu bilangan sehingga memberikan suatu bilangan bulat.
Agar diperoleh bilangan bulat maka kedua ruas dikali 2, sehingga
diperoleh persamaan reaksi yang setara dengan koefisien dalam bentuk
bilangan bulat:
4) Biasanya oksigen disetarakan paling terakhir jika masih terdapat unsur-unsur lain.
Contoh
Reaksi gas metana (CH4) dengan gas oksigen membentuk gas
karbon dioksida dan uap air. Tulislah persamaan reaksi dan setarakan
persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi
yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya
disetarakan huruf sebagai kofisien sementara.
CH4 = 1, koefisien zat yang lain disetarakan dengan huruf, maka persamaan reaksinya menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Dari reaksi tersebut unsur yang beriktan langsung dengan zat telah diberi koefisien 1 adalah C dan H.
penyetaraan atom C
Atom C diruas kiri = 1
Atom C diruas kanan = b
Maka jumlah atom C diruas kanan = b = 1
Penyetaraan atom H
Jumlah atom H di ruas kiri = 4
Jumlah atom H di ruas kanan = 2c
Maka jumlah atom H di ruas kanan atau harga koefisien c = 2c = 4, c = 2
Dari penyetaraan ini maka persamaan reaksi menjadi
4. Setarakan atom O
Jumlah atom O di ruas kanan = 2 + 2 = 4
Jumlah atom O di ruas kiri = 2a
Maka jumlah atom O di ruas kiri atau harga koefisien a = 2a = 4, a = 2
Maka persamaan reaksinya menjadi:
Catatan: koefisien 1 biasanya tidak ditulis, penulisan du atas dan
untuk penyetaraan reaksi selanjutnya hanya untuk memberikan gambaran
mengenai tahap-tahap penyetaraan saja.
Contoh
Reaksi besi(III) oksida dengan larutan asam sulfat
membentuk besi(III) sulfat dan air. Tulislah persamaan reaksi dan
setarakan persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi
yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya
disetarakan huruf sebagai kofisien sementara.
Koefisien Fe2(SO4)3 = 1 dan koefisien yang lain menggunakan huruf. Persamaan reaksi menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Dari reaksi tersebut unsur yang beriktan langsung dengan zat telah
diberi koefisien 1 adalah Fe, S dan O. Namun O disetarakan terakhir
karena unsur O terdapat di lebih dari dua zat.
Penyetaraan atom Fe
Jumlah atom Fe di ruas kiri = 2a
Jumlah atom Fe di ruas kanan = 2
Maka jumlah atom Fe diruas kiri atau harga koefisien a = 2a = 2, a = 1
Penyetaraan atom S
Jumlah atom S di ruas kiri = b
Jumlah atom S di ruas kanan = 3
Maka jumlah atom S di ruas kiri atau harga koefisien b = 3
Persamaan reaksinya menjadi:
4. Setarakan atom lainnya. Atom O disetarakan setelah semua atom setara.
Penyetaraan atom H
Jumlah atom H di ruas kiri = 6
Jumlah atom H di ruas kanan = 2c
Maka jumlah atom H di ruas kanan atau harga koefisien b = 2c = 6, c = 3
Persamaan reaksinya menjadi:
5. Setarakan atom O. Karena semua atom telah setara, maka oksigen
seharusnya telah setara juga. Untuk meyakinkan jumlah atom O pada kedua
ruas telah setara, maka dilakukan penjumlahan atom O pada kedua ruas.
Jumlah atom O di ruas kiri = 3 + 12 = 15
Jumlah atom O di ruas kanan = 12 + 3 = 15.
Dari penjumlahan ini, terbukti jumlah atom O pada ruas kiri dan ruas
kanan telah setara. Jadi persamaan reaksi setaranya adalah sebagai
beriktu:
Contoh
Reaksi antara tembaga dengan larutan asam nitrat encer
menghasilkan tembaga(II) sulfat, gas nitrogen oksida dan air. Tulislah
persamaan reaksi dan setarakan persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi
yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya
disetarakan huruf sebagai kofisien sementara.
Koefisien Cu(NO3)2 = 1, dan koefisien yang lain menggunakan huruf. Persamaan reaksi menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Pada reaksi di atas, hanya Cu yang dapat langsung disetarakan yaitu a
= 1. Untuk unsur yang lainnya walaupun terkait langsung dengan Cu(NO3)2
tetapi tidak dapat langsung disetarakan karena terdapat di lebih dari
dua zat yang belum mempunyai harga korfisien. Maka untuk menyetarakannya
ikuti persamaan-persamaan berikut:
· Menyetarakan atom N : b = 2 + c ……………………… (1)
· Menyetarakan atom H : b = 2d …………………………. (2)
· Menyetarakan atom O : 3b = 6 + c + d ……………… (3)
Dari persamaan-persamaan di atas nyatakan nilai c dan d dalam b, sebagai berikut:
· Dari persamaan (1), b = 2 + c berarti c = b – 2
· Dari persamaan (2), b = 2d berarti d = 0,5 b
Substitusikan nilai c cdan d ke dalam persamaan (3)
3b = 6 + c + d
3b = 6 + b – 2 + 0,5 b
1,5b = 4
nilai b yang telah diperoleh di substitusikan ke persamaan (1) dan
(2) untuk memperoleh nilai c dan d. Maka nilai c dan d berturut-turut
adalah 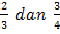
Maka persamaan reaksinya menjadi:
karena masih dalam bentuk pecahan maka dikalikan 3 sehingga diperoleh koefisien dalam bentuk bilangan bulat.
Sifat persamaan reaksi
a. Jenis unsur-unsur sebelum dan sesudah reaksi selalu sama
b. Jumlah masing-masing atom sebelum dan sesudah reaksi selalu sama
c. Perbandingan koefisien reaksi menyatakan perbandingan mol. Khusus
untuk yang berwujud gas perbandingan koefisien menyatakan perbandingan
volume pada suhu den tekanannya sama.
Stoikiometri Reaksi
Hubungan mol dengan koefisien reaksi
Seperti yang telah dijelaskan pada bagian-sebelumnya,
koefisien zat dalam suatu persamaan reaksi menyatakan jumlah mol zat
itu. Oleh sebab itu jumlah mol zat atau massa zat yang terlibat dalam
suatu reaksi dapat ditentukan. Aspek kuantitatif zat-zat yang terlibat
dalam dalam reaksi inilah yang disebut stoikiometri reaksi.
Stoikiometri reaksi ini sangat diperlukan terutama dalam merencanaakan
banyaknya zat yamg akan dihasilkan dari suatu reaksi kimia dalam
industri maupun dalam laboratorium.
Dengan mengeahui koefisien persamaan reaksi
maka jumlah mol suatu zat dalam persamaan reaksi telah diketahui. Mol
zat yang telah diketahui dapat digunakan untuk menentukan massa zat yang
diperlukan dalam suatu reaksi. Karena hal tersebut koefisien reaksi
disebut sebagai dasar stoikiometri reaksi.
Contoh
Logam aluminium yang dilarutkan ke dalam asam sulfat menghasilkan aluminium sulfat dan gas hidrogen, sesuai reaksi berikut:
Berapa mol mol gas hidrogen yang dihasilkan jika digunakan 0,5 mol aluminium yang dilarutkan dalam asam sulfat?
Jawab
artinya dengan melarutkan 0,5 mol aluminium menghasilkan 0,75 mol gas hidrogen.
Dari mol gas hidrogen yang telah diketahui dapat ditentukan massa
hidrogen yang dihasilkan. Massa hidrogen dapat ditentukan dengan cara
mengalikan mol hidrogen yang diperoleh dengan Mr.H2.
Contoh
Perhatikan reaksi berikut:
Berapa volume gas hidrogen (STP) yang terbentuk jika digunakan 5,4 gram Al? (Ar Al = 27)
Jawab
a) Setarakan reaksi kimia yang terjadi jika persamaan reaksi belum
setara. Pada persamaan reaksi di atas telah setara sehingga tidak perlu
disetarakan.
b) Menyatakan jumlah mol zat yang diketahui, yakni aluminium.
c) Menentukan jumlah mol zat yang ditanyakan yakni gas H2.
d) Menentukan volume gas H2 yang dihasilkan
V = n x Vm
= 0,3 mol x 22,4 L mol‾1 = 6,72 L.
Hipotesis Avogadro dan Hubungan Volume dengan Koefisien Reaksi
Pada tahun 1811, Ameo Avogadro mengemukakan sebuah hipotesis yang mengatakan: “pada
tekanan (P) dan suhu (T) yang sama, gas-gas yang memiliki volume sama
mengandung jumlah molekul (jumlah mol) yang sama pula”.
Artinya pada P dan T sama, perbandingan volume gas-gas yang terlibat
dalam suatu reaksi sama dengan perbandingan jumlah mol zat yang terlibat
dalam reaksi tersebut. Karena pada persamaan reaksi, koefisien
menyatakan jumlah mol zat, maka volume gas yang terlibat dalam suatu
reaksi sama dengan koefisien zat itu.
Hubungan antara koefisien suatu zat dengan volume dapat dirumuskan sebagai berikut:
 |
Contoh
Pada suhu dan tekanan tertentu 0,5 mol gas oksigen
volumenya adalah 2 liter. Hitunglah volume dari 1,5 mol gas hidrogen
pada suhu dan tekanan yang sama dengan gas oksigen tersebut
Jawab
Contoh
Tentukan berapa volume gas belerang trioksida (SO3) yang dihasilkan dan berapa volume gas O2 yang dibutukan, jika direaksikan 1 liter gas belerang dioksida (SO2) dengan gas oksigen?
Jawab
Persamaan reaksi
SO2 yang bereaksi = 1 liter


 00.19
00.19
 Fhadhyla
Fhadhyla

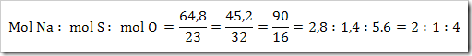
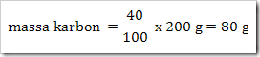
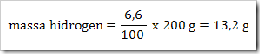
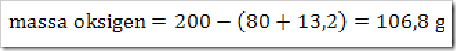


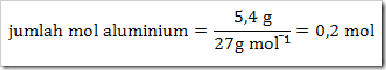



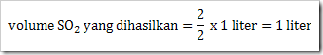







0 komentar:
Posting Komentar